实验简介
悬尾实验(Tail Suspension Test, TST)是评估动物抑郁样行为(核心为 “无助行为”) 的经典行为学实验,由 Steru 于 1985 年建立。其核心原理是利用动物被尾部悬挂时 “无法逃离困境” 的场景,通过观察并量化其 “不动时间” 来反映无助感,广泛应用于小鼠,是抗抑郁药物筛选、抑郁模型验证及抑郁机制研究的核心工具之一。
核心实验原理
动物天生具有 “挣扎求生、摆脱束缚” 的本能,被尾部悬挂后,初期会表现出剧烈挣扎行为(如身体扭动、四肢划动、试图翻转);随着时间推移,当动物意识到无法逃离时,会逐渐减少主动挣扎,进入 “不动状态”(仅保持身体静止下垂,最小化能量消耗)。
这种 “不动时间” 是抑郁样行为的核心指标——不动时间越长,说明动物无助感越强,抑郁样表型越明显;反之,抗抑郁药物干预后,动物不动时间会显著缩短,主动挣扎行为增加。
1.抗抑郁药物筛选:是药物研发中 “体内抗抑郁活性初筛” 的核心实验——候选药物若能显著缩短动物不动时间、增加挣扎时间,提示其可能具有抗抑郁潜力(如氟西汀、文拉法辛等经典药物可降低不动时间)。
2. 抑郁模型验证:用于验证 “应激诱导抑郁模型”(如慢性不可预见性温和应激、社交挫败模型——模型组动物不动时间显著长于正常对照组,证明模型构建成功。
3. 抑郁机制研究:探究基因、神经通路对抑郁样行为的调控(如 5-羟色胺、多巴胺通路),例如敲除 “5-羟色胺受体基因”的小鼠,不动时间会显著增加,为抑郁机制研究提供行为学证据。
实验前准备
■ 实验动物:
● 根据研究目的选择合适品系的啮齿动物。注意不同品系、年龄、性别可能存在基线差异。
● 筛选动物:需选择身体健康状况良好的动物,排除生病、受伤及尾部有炎症的动物;通常不使用大鼠,谨慎选择体重异常过重的啮齿动物(例如用于肥胖模型研究的啮齿动物)。雌性动物需避开发情期(激素波动可能影响行为)
● 避免实验前应激:实验前一周进行单笼饲养;测试前24小时内,忌对实验动物进行其他可能引起应激的操作或实验。
● 提前30-60分钟将实验动物从饲养房间转移至测试区域,以适应新环境。
■ 实验环境:
标准饲养笼,自由饮水、进食。
光照均匀稳定,光强500lx,保持稳定的12:12反向明/暗循环。
室温恒温22±1摄氏度,湿度(50±20)%。
保持室内安静,控制噪声55~70dB,可添加白噪声。
■ 实验装置:
○ 悬尾实验箱(定制咨询客服)
外壳为医用有机板,每个隔间尺寸不低于55cm高* 15cm宽 11.5cm,颜色根据实验动物毛色选择对比度强的纯色。
顶部有平行于地面的铝制悬挂杆,杆中间配置一固定挂钩。
底部选配可拆卸铝托盘,用于手机动物的尿液及粪便。
防爬装置:空心圆柱体,长度4cm,外径1.6cm,聚碳酸酯管材;用于套住小鼠尾巴防止攀爬。


(单悬尾(左侧)、悬尾&强迫游泳(右侧))


(单隔间(左侧)、四通道(右侧))
小鼠被悬挂在隔间中央,隔间宽度足以防止小鼠与两侧壁接触;相邻隔间中央的隔板为非透明颜色,避免实验动物间互相观察或接触。
PROTOCOL
环境控制
1. 提前将小鼠运至测试区域,对实验鼠按需进行标记。
2. 关闭环境光,打开白噪声。
3. 固定相机,调整位置、焦距、图像参数等,确保采集到的实验画面清晰完整。
4. 放置好托盘,清洁箱体,去除干扰物及无关气味。
对象控制
1. 用防爬装置套上小鼠尾巴(根据需要选择)
2. 剪下17cm长的胶带片段,一端粘贴位置在小鼠尾尖2cm处或1/3处,另一端固定于箱体(整个过程需快速完成),保持小鼠尾巴基部与水平面对齐
3. 小鼠固定好后工作人员快速离开,分析软件即开始录制
4. 启动测试,在分析软件预设6分钟(2分钟“适应期”+4分钟“记录期”)计时结束后,实验即观察完成
5. 将动物释放,小心去除胶带,擦拭尾巴,送回饲养笼
6. 清理托盘中的粪便及尿液,用消毒溶液擦拭实验设备
数据记录分析
1. 行为检测:
○ 静止——当老鼠仅通过尾巴悬挂而未进行任何主动行为时,即为静止(持续至少5秒)
○ 摆动——老鼠持续以垂直姿势移动爪子同时保持身体直立或身体左右移动
○ 蜷缩——老鼠整个身体进行主动扭转动作
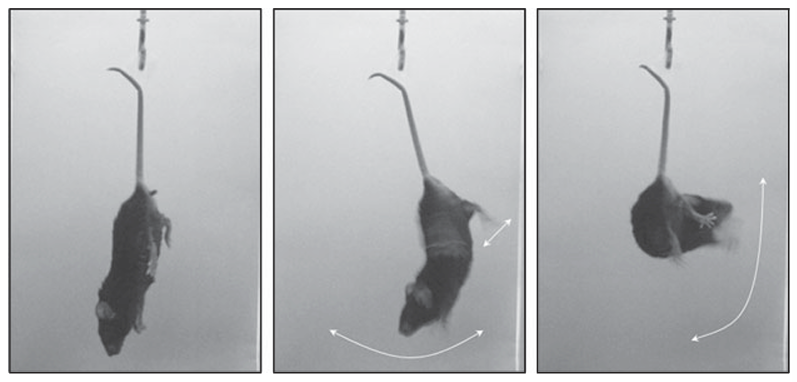
2. 数据分析(主要为后4分钟的行为变化)
○ 单次静止时间:单次静止行为的持续时间
○ 总静止时间:4分钟内累计静止的时间
○ 不动时间百分比:(不动持续时间/240秒)*100%
○ 挣扎次数:主动挣扎/扭动的次数
○ 首次静止潜伏期:从测试开始至第一次出现○ 静止行为的时间
注意事项
1. 胶带固定。小鼠尾部胶带固定点、固定方式均须统一。
位置:靠近根部会导致因疼痛挣扎增加,靠近尾尖则胶带易脱落。
松紧:过紧易增加小鼠痛感,过松胶带易脱落。
2. 观察时间不宜超过6分钟,最长不超过10分钟。悬尾实验随时间延长,小鼠感受到的痛苦将成倍增加;且过长的时间对于数据无统计意义。
3. 同一只动物同一天内不宜重复测试。
悬尾与强迫游泳(TST&FST)
悬尾与强迫游泳类似,实验动物都会被置于一种无法逃脱且有一定压力的环境中,缺乏逃避相关行为则被视为静止不动,静止不动的相关指标则与抑郁状态挂钩。
两种实验差异也十分明显。主要体现在三方面:一是实验环境不同,悬尾实验无需水环境,仅通过尾部悬挂实现,操作更简洁,避免水温、水质等变量干扰;强迫游泳实验依赖控温水箱,需处理水体与动物干燥,步骤更繁琐。二是应激源类型不同,悬尾实验应激源为 “身体束缚与悬空”,强迫游泳实验则叠加 “水环境与体力消耗”,后者对动物的综合应激更强。三是适用场景侧重不同,悬尾实验因操作简便、耗时短,更适合大样本药物初筛;强迫游泳实验因能同时观察游泳、挣扎等多种行为,更适合精细分析动物运动能力与无助感的关联。
|
上一条:沒有啦!
下一条:洞板实验(Holeboard Test) |
返回列表 |